2021年4月28日,amjs澳金沙门线路李力/高维强课题组在美国癌症研究学会(AACR)旗下国际著名肿瘤学期刊Cancer Research上在线发表了题为“Multi-level regulation of β-catenin activity by SETD2 suppresses the transition from polycystic kidney disease to clear cell renal cell carcinoma”的研究论文,证实了组蛋白甲基化酶SETD2可以多水平调控的β-catenin活性,从而抑制多囊肾病向肾透明细胞癌的转化。
多囊肾病(PKD)是由肾上皮细胞过度增殖引起的最常见的遗传性肾病,是终末期肾病的主要原因之一。肾细胞癌(RCC)也起源于肾小管上皮,是造成泌尿系统所有类型癌症死亡的第二大原因。临床上,多囊肾病患者发展为肾细胞癌的几率更高,说明多囊肾病的患者具有较高的肾细胞癌风险,但其中的关键机制尚不清楚。
SETD2是一种表观遗传调控因子,具有组蛋白甲基转移酶活性,是肾细胞癌中高突变的基因之一(约12%),它的缺失与多种疾病的发生发展相关。李力副研究员在2014年建立了Setd2条件性基因敲除小鼠模型并在生殖、发育和癌症等领域展开广泛的功能研究(Zuo et al, J Bio Chem, 2018; Wang et al, PLoS Biol, 2018; Xu et al, Nat Genet, 2019; Ji et al, Nat Commun, 2019; Niu et al, Gut, 2020; Li et al, Hepatology, 2020; Li et al, Cell Proliferat, 2021)。在此基础上,李力/高维强课题继续探究肾细胞癌中高突变基因SETD2在肾细胞癌发展过程中的作用。研究人员发现在转基因动物模型中,过表达的c-MYC可以引起多囊肾病,而同时SETD2的缺失可以促进这种多囊肾病最终发展成为典型的肾透明细胞癌(ccRCC)。
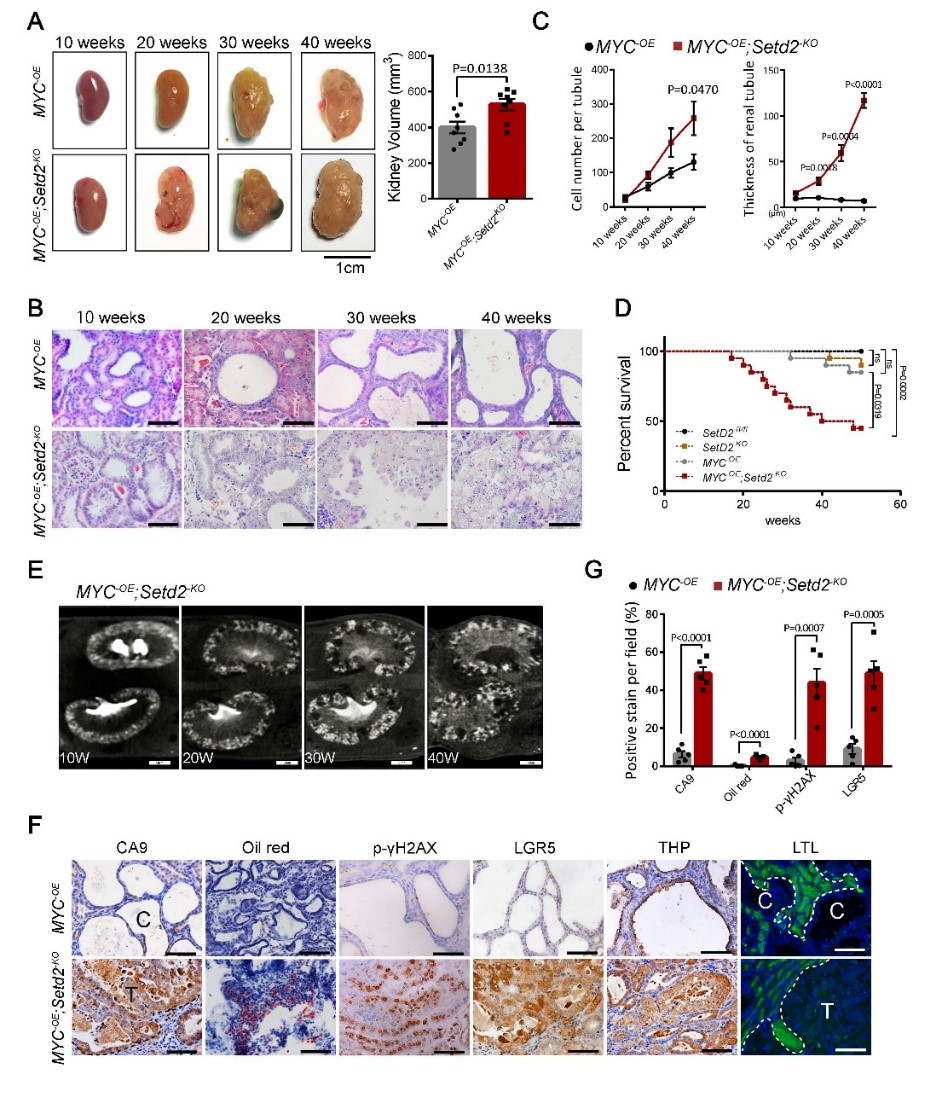
图1 SETD2缺失导致c-MYC引起的多囊肾病转化为肾透明细胞癌
进一步的分子机制研究表明,SETD2通过与β-catenin在其靶基因启动子区域的竞争性结合,同时通过组蛋白H3K36位点的三甲基化调控促进“β-catenin破坏复合物”成员的表达,可以在转录调控和蛋白质复合体的水平上抑制β-catenin的活性。利用β-catenin抑制剂处理c-MYC过表达且SETD2缺失的小鼠,可以明显的减轻这些动物的肾透明细胞癌表型。因此,SETD2作为一个重要的肿瘤抑制基因,它的缺乏可以导致Wnt/β-catenin信号上调和上皮-间充质转化过程的增强,从而促进多囊肾病发展成为肾细胞癌。

图2 β-catenin抑制剂减轻c-MYC过表达和SETD2缺失导致的肾透明细胞癌表型
这些结果拓宽了SETD2作为表观遗传调控因子和转录调控因子的研究范围。同时,针对SETD2与WNT/β-catenin信号通路的靶向药物开发研究也将为具有高肾细胞癌风险的多囊肾病患者提供了一种新的预防和治疗策略。本文所构建的基因工程小鼠模型也将为此类疾病的临床前研究提供有益的帮助。

图3 SETD2多水平调控β-catenin活性,抑制多囊肾病向肾透明细胞癌的转化
amjs澳金沙门线路博士研究生饶汉钰为该论文的第一作者,李力副研究员和高维强教授为该论文的共同通讯作者。该研究课题得到了国家科技部,国家自然科学基金委,上海市科委和高峰高原学科的资助。
原文链接: https://doi.org/10.1158/0008-5472.can-20-3960
供稿单位:科研与学科办
撰稿人:饶汉钰
